Teori Atom Dalton berdasarkan pemikiran bahwa konsep atom Democritus sesuai dengan Hukum Kekekalan Massa (berbunyi: massa zat sebelum dan sesudah reaksi sama) dan Hukum Perbandingan Tetap (berbunyi: perbandingan massa unsur-unsur dalam suatu senyawa adalah tetap dan tertentu), maka John Dalton tahun 1803 merumuskan 5 teori atom sebagai berikut.
a. Materi tersusun atas partikel-partikel terkecil yang disebut atom.
b. Atom-atom penyusun unsur bersifat identik (sama dan sejenis).
c. Atom suatu unsur tidak dapat diubah menjadi atom unsur lain.
d. Senyawa tersusun atas 2 jenis atom atau lebih dengan perbandingan tetap dan tertentu.
e. Pada reaksi kimia terjadi penataulangan atom-atom yang bereaksi. Reaksi kimia terjadi karena pemisahan atom-atom dalam senyawa untuk kemudian bergabung kembali membentuk senyawa baru.
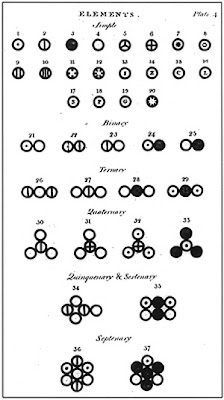 |
| Variasi atom dan molekul model Dalton. |
Kelebihan Teori Atom Dalton :
- Dapat menerangkan Hukum Kekekalan Massa (Hukum Lavoisier).
- Dapat menerangkan Hukum Perbandingan Tetap (Hukum Proust).
Dalam perkembangannya tidak semua teori atom Dalton benar, karena pada tahun 1897 J.J.Thomson menemukan partikel bermuatan listrik negatif yang kemudian disebut elektron. Tahun 1886 Eugene Goldstein menemukan partikel bermuatan listrik positif yang kemudian disebut proton. Dan tahun 1932 James Chadwick berhasil menemukan neutron.
Salah satu hipotesis Dalton adalah reaksi kimia dapat terjadi karena penggabungan atom-atom atau pemisahan gabungan atom. Misalnya, logam natrium bersifat netral dan reaktif dengan air dan dapat menimbulkan ledakan. Jika logam natrium direaksikan dengan gas klorin yang bersifat racun dan berbau merangsang, maka akan dihasilkan NaCl yang tidak reaktif terhadap air, tidak beracun, dan tidak berbau merangsang seperti logam natrium dan gas klorin.
Karena ada banyak hal yang tidak dapat diterangkan oleh teori atom Dalton, maka para ilmuwan terdorong untuk melakukan penyelidikan lebih lanjut tentang rahasia atom.
Intinya :
Model atom Dalton mempunyai beberapa kelemahan. Beberapa kelemahan itu diantaranya :
a. Tidak dapat menjelaskan sifat listrik materi atom.
b. Tidak dapat menjelaskan gaya gabung unsur-unsur. Misalnya, mengapa dalam pembentukan air (H2O) satu atom oksigen mengikat dua atom hidrogen.
c. Pada kenyataannya atom dapat dibagi lagi menjadi partikel yang lebih kecil yang disebut partikel subatomik.
Sumber : http://perpustakaancyber.blogspot.com/2013/03/model-dan-kelemahan-teori-atom-dalton-pengertian-gambar.html#ixzz2f9d3puoE

Tidak ada komentar:
Posting Komentar